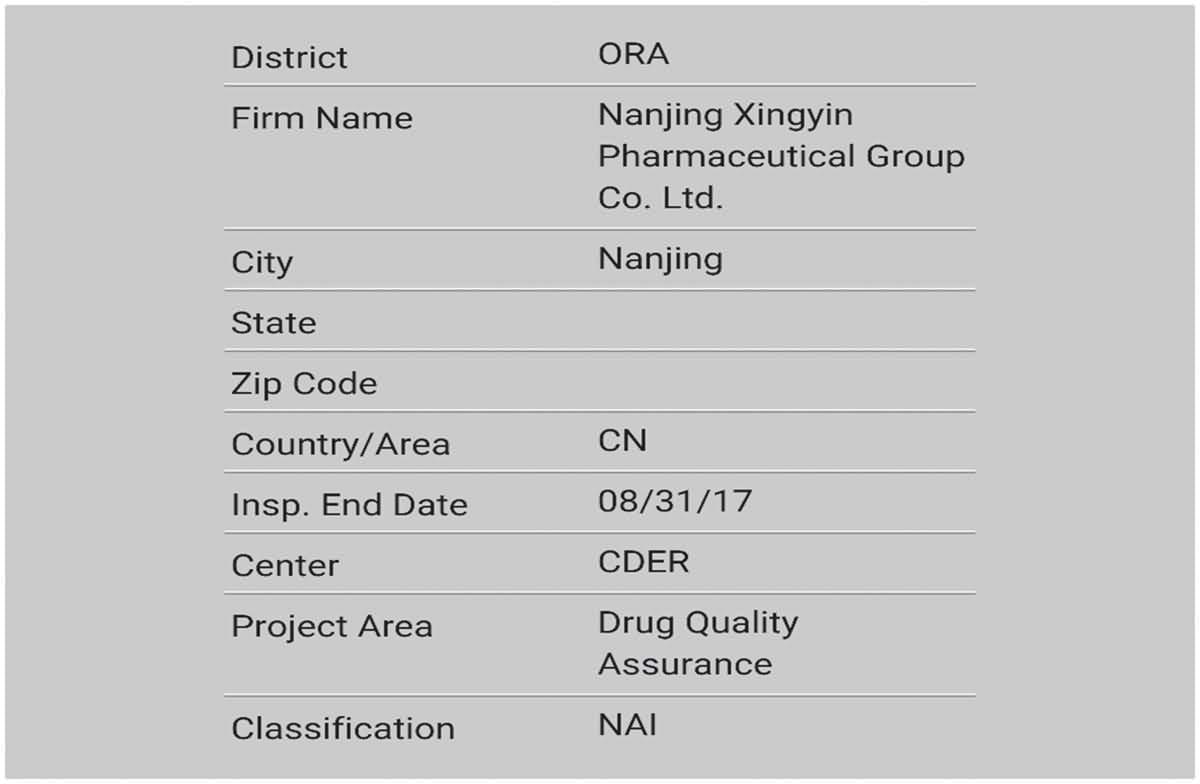
Parabéns calorosamente á nosa División de Produtos Polipeptídicos por superar con éxito a inspección in situ da FDA dos Estados Unidos con "cero defectos"!
Superar a inspección in situ da FDA con "cero defectos" é un acontecemento importante na nosa historia de desenvolvemento de cGMP. Non só significa que o noso API obtivo o pasaporte para entrar no mercado estadounidense, senón que tamén demostra que a implementación de cGMP na nosa empresa foi aliñando gradualmente os estándares internacionais.
Data de publicación: 02-03-2019







